共同研究者から、環境汚染物質が塩素消毒によって変化するのでその変化体を高分解能 MS で調べて欲しいと依頼されました。渡された文献見ると、塩素処理は次亜塩素酸ナトリウムでやっていると。
水道水質基準でシアンの分析をするとき同時に測る塩化シアンは有効塩素 0.001% の次亜塩素酸ナトリウム水溶液で塩素化しているな。
しかし、市販の次亜塩素酸ナトリウム水溶液は有効塩素 〜 % で売られているのだけどモル濃度はどの程度なんだろう。
塩素化するにあたって、次亜塩素酸が塩素化対象物に対して物質量で同程度なのか過剰なのか。しかし、COVID-19 関連で消毒剤不足もあったせいか、色んなところが Web に消毒剤の話を掲載しているけど不安になる情報が多いような。有効塩素の塩素は普通に考えて Cl2 のことだと思うのだけど、塩素原子として書いている情報もちらほら。。。
pH に応じて存在状態が酸型 HClO, 解離型 ClO– となるだけでなく、酸性条件下では Cl2 になるらしい。
これを Cl2 換算して有効塩素と言っているのだろう。
酸化反応は
Cl2 + 2e– → 2Cl–
ClO– + 2H+ + 2e– → Cl– + H2O
なので、反応で出入りする電子の数は同じ。酸化反応において Cl2 1 mol は ClO– 1 mol に相当するということですね。
有効塩素の塩素が塩素分子に相当するのか、塩素原子に相当するのかが気になって調べていたら
水道協会さんの水道用次亜塩素酸ナトリウムの試験方法に有効塩素を求める試験法が載っていた。
酸化還元反応で学生実験でも良く出てくる、ヨウ化カリウムを塩素処理で酸化してヨウ素分子にして
これがデンプンと作る青色にチオ硫酸ナトリウム水溶液を加えて、色が消えるところを見る滴定ですな。
載っている式を見ると有効塩素濃度 A (%) として
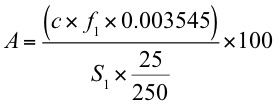
となっている。c は 0.1 mol/L のチオ硫酸ナトリウム溶液の消費量 (mL) 、f1 はそのファクター、
S1 は次亜塩素酸ナトリウム水溶液試料の量 (g) だそうで。
括弧の中の 3545 が塩素の原子量 35.45 から来ていると読み取って塩素原子に相当するとする情報が出てくるのかな。
同じような式は日本ソーダ工業会規格「次亜塩素酸カルシウム試験方法(高度さらし粉試験方法)」にもありますね。有効塩素を C (%) として
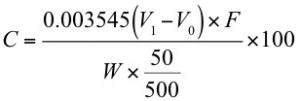
という式がある。500 や 250 というのは試料を希釈している時の液量のようです。
次亜塩素酸ナトリウム水溶液だろうがさらし粉だろうが、酸化反応の担い手は ClO– か Cl2 だけど
ClO– で考えると、ヨウ化カリウムからヨウ素を生じる反応は
ClO– + 2H+ + 2I– → I2 + H2O + Cl–
滴定での反応は
2Na2S2O3 + I2 → 2NaI + Na2S4O6
ということで、ClO– 1 mol で生じる I2 は 2 mol の Na2S2O3 で消費されることになる。
水道の試験法では試料 S1 (g) をとって、250 mL メスフラスコを使って希釈して、その内 25 mL を滴定に使っている。つまり 1/10。チオ硫酸ナトリウム水溶液 1 mL に含まれるチオ硫酸ナトリウムの物質量は
0.1 × 1 / 1000 × f1 (mol)
ClO– の物質量はその半分になる。有効塩素は質量パーセントということで、塩素換算の質量 ÷ 試料量 × 100 ということ。
0.05 × 1 / 1000 × f1 × c × M / S1 × 25/250
M は原子量か分子量ということで、元の式の 0.003545 と見比べると
M = 70.9 となるのでで、やっぱり有効塩素の塩素は塩素分子ということか。
10% 有効塩素の次亜塩素酸ナトリウム水溶液の比重は 1.2 くらいなので、水溶液 1 L あるとしたらその中にCl2は 120 g、これは 1.7 mol。
ClO– にして 1.7 M と考えればよいか。